Аллотропные формы, сравнение кристаллических решёток алмаза и графита и их свойств
Углерод существует во множестве аллотропных модификаций с очень разнообразными свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа.
Аллотропные модификации углерода по своим свойствам радикально (преимущественно) отличаются друг от друга.
Классификация аллотропных форм углерода по характеру химической связи между атомами:
- sp3 формы:
- sp2 формы:
- Графит
- Графены
- Фуллерены
- Углеродные нанотрубки
- Углеродные нановолокна
- Астралены
- Стеклоуглерод
- Колоссальные углеродные трубки
- sp формы:
- Смешанные sp3/sp2 формы:
- Аморфный углерод
- Углеродные нанопочки
- Углеродная нанопена
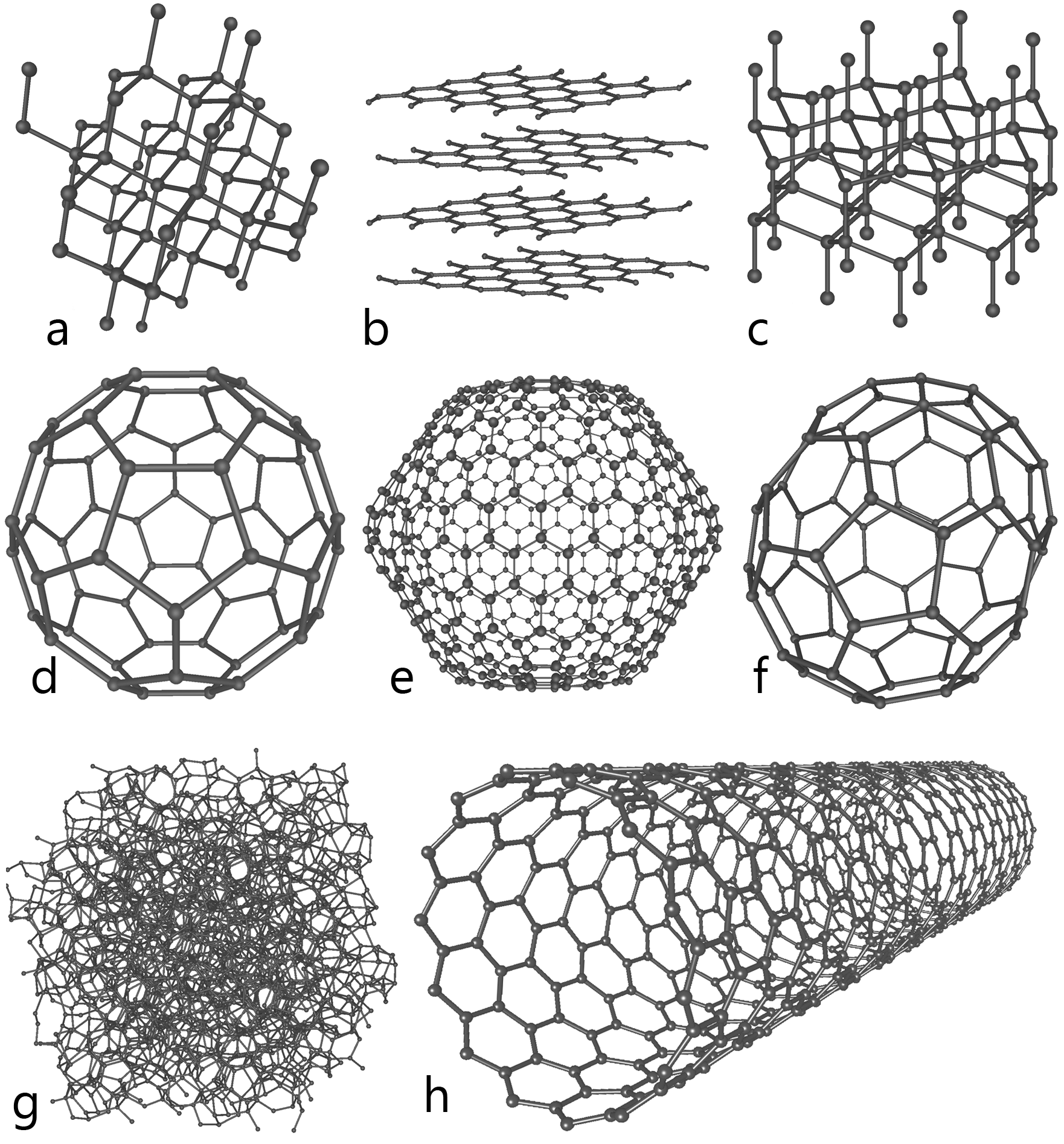
|
Рис. 3. Восемь аллотропных модификаций углерода:
a) алмаз,
b) графит,
c) лонсдейлит,
Фуллерены: d) C60, e) C540, f) C70,
g) аморфный углерод,
h) однослойная углеродная нанотрубка.
|
Наиболее подробно рассмотрим кристаллические решётки двух аллотропных форм углерода: алмаза и графита.
Алмаз
 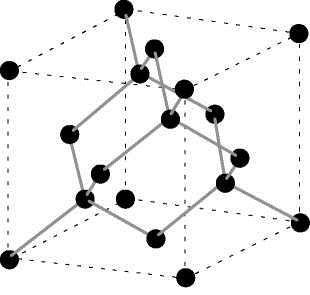
Рис. 4. Структура алмаза.
|
Тип кристаллической решётки: кубическая гранецентрированная. Атомные орбитали углерода в алмазе находятся в состоянии sp³-гибридизации, определяющей отсутствие способности алмаза проводить электрический ток. Каждый атом углерода в структуре алмаза расположен в центре тетраэдра, вершинами которого служат четыре ближайших атома. Каждый из атомов связан со своими четырьмя ближайшими «соседями», симметрично расположенными по его вершинам (тетраэдра), наиболее «прочной» химической связью — ковалентной. Именно прочная связь атомов углерода и их вышеописанное положение объясняет высокую твёрдость алмаза.
Графит
Наиболее термодинамически устойчивой, при нормальных условиях, формой углерода является графит, представляющий собой стопку слабо связанных между собой графеновых листов — плоских решеток из шестиугольных ячеек с атомами углерода в вершинах. Каждый атом углерода ковалентно связан с тремя другими окружающими его атомами углерода, отсюда sp2-гибридизация.
Различают две модификации графита: α-графит (гексагональный) и β-графит (ромбоэдрический). Различаются упаковкой слоёв. У α-графита половина атомов каждого слоя располагается над и под центрами шестиугольника, а у  β-графита каждый четвёртый слой повторяет первый. Ромбоэдрический графит удобно представлять в гексагональных осях, чтобы показать его слоистую структуру. β-графита каждый четвёртый слой повторяет первый. Ромбоэдрический графит удобно представлять в гексагональных осях, чтобы показать его слоистую структуру.

Рис. 5. Структура α-графита.
|
β-графит в чистом виде не наблюдается, так как является метастабильной фазой. Однако в природных графитах содержание ромбоэдрической фазы может достигать 30 %. При температуре 2500-3300 К ромбоэдрический графит полностью переходит в гексагональный.
 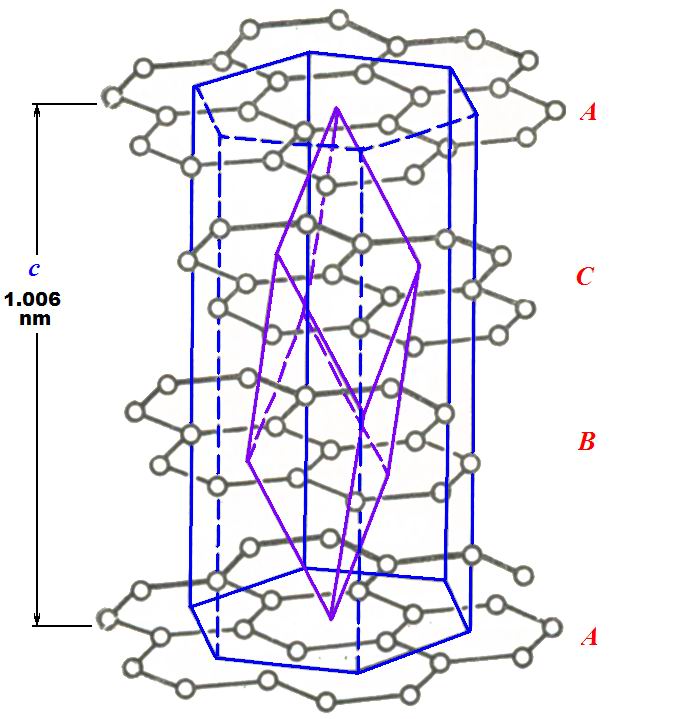
Рис. 6. Структура β-графита.
|
В отличие от алмаза, графит обладает низкой твёрдостью, способен проводить электричество, относительно мягкий. После воздействия высоких температур становится немного тверже, и очень хрупким. При трении расслаивается на отдельные чешуйки (это свойство используется в карандашах).
К содержанию.
| 