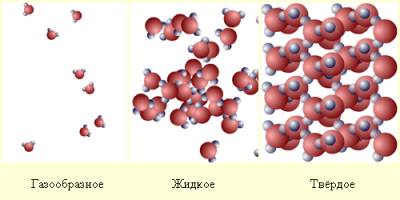
Агрегатные состояния вещества
План
1.Введение
2.Агрегатное состояние вещества
3.Агрегатное состояние вещества – газ
4.Агрегатное состояние вещества – жидкость
5.Агрегатное состояние вещества – твердое тело
6.Четвертое состояние вещества – плазма
7. Опыт: изменение агрегатного состояния воды
8.Заключение
Введение
Как известно, многие вещества в природе могут находиться в трех состояниях: твердом, жидком и газообразном. А также некоторые могут находиться еще и в четвертом - плазматическом состоянии Я выбрал данную тему потому что многие вещества используются в жизни и в разных агрегатных состояниях. Целью данной работы является – рассмотреть существующие агрегатные состояния вещества, выявить все их достоинства и недостатки.
Агрегатные состояния вещества
Взаимное расположение, характер движения и взаимодействия молекул одного и того же вещества существенно зависящие от внешних условий (температура, давление), характеризуют его агрегатное состояние. Различают четыре агрегатных состояния вещества: твердое, жидкое, газообразное, плазменное. Фазовый переход – переход системы из одного агрегатного состояния в другое. При фазовом переходе скачкообразно изменяется какая-либо физическая величина (например, плотность, внутренняя энергия) или симметрия системы. Переход вещества из твердого состояния в жидкое называется плавлением, а температуру, при которой это происходит – температурой плавления. Переход вещества из жидкого состояния в твердое называется кристаллизацией, а температуру перехода – температурой кристаллизации. Переход вещества из жидкого состояния в газообразное называется парообразованием. Переход вещества из газообразного состояния в жидкое называется конденсацией. Реализация того или иного агрегатного состояния вещества зависит от соотношения кинетической и потенциальной энергии молекул, входящих в его состав. Потенциальная энергия молекулы характеризует степень ее связи с другими частицами. Между любыми двумя молекулами вещества на расстоянии, большем диаметра молекул, действуют силы притяжения электромагнитного происхождения. Эти силы стремятся связать молекулы в единое целое. Кинетическая энергия молекул препятствует этой тенденции сцепления их между собой.
Газ

Газ (газообразное состояние) – одно из четырех агрегатных состояний вещества, характеризующееся очень слабыми связями между составляющими его частицами (молекулами, атомами или ионами), а также их большой подвижностью. Частицы газа почти свободно и хаотически движутся в промежутках между столкновениями, во время которых происходит резкое изменение характера их движения. Так же термин «газ» можно определить как вещество, температура которого равна или превышает критическую точку, при такой температуре сжатие газа не приводит к образованию жидкости. В этом и заключается отличие газа от пара. При повышении давления насыщенный пар частично превращается в жидкость, газ нет. Вещество находится в газообразном состоянии, если средняя кинетическая энергия молекул превышает их среднюю потенциальную энергию. Газообразное состояние вещества в условиях, когда возможно существование устойчивой жидкой или твёрдой фазы этого же вещества, обычно называется паром. Подобно жидкостям, газы обладают текучестью и сопротивляются деформации. В отличие от жидкостей, газы не имеют фиксированного объёма и не образуют свободной поверхности, а стремятся заполнить весь доступный объём (например, сосуда). Газы могут неограниченно расширяться в пространстве, так как силы притяжения между молекулами незначительны. Большая сжимаемость газов по сравнению со сжимаемостью жидкостей и твердых тел объясняется наличием большего межмолекулярного пространства (рис.1).
Рис.1
При сжатии газа уменьшается среднее расстояние между его молекулами. Однако силы взаимного отталкивания молекул на этом расстоянии невелики и практически не препятствуют сжатию.
ЖИДКОСТЬ
Жидкость — вещество, находящееся в жидком агрегатном состоянии, занимающем промежуточное положение между твёрдым и газообразным состояниями. Вещество находится в жидком агрегатном состоянии, если средняя кинетическая энергия молекул соизмерима со средней потенциальной энергией их притяжения. Основным свойством жидкости, отличающим её от веществ, находящихся в других агрегатных состояниях, является способность неограниченно менять форму под действием касательных механических напряжений, даже сколь угодно малых, практически сохраняя при этом объём. При нагревании твердого тела средняя кинетическая энергия молекул, колеблющихся около положений равновесия, возрастает. Рост кинетической энергии молекул приводит к увеличению амплитуды ее колебаний. Уменьшение энергии связи при нагревании позволяет молекулам перескакивать из одного положения равновесия в другое. В результате нарушается правильное расположение частиц, характерное для кристаллической решетки твердого тела. Происходит фазовый переход вещества из твердого состояния в жидкое. Молекулы в жидкости упакованы так же плотно, как и в твердом теле, так как плотность жидкости и твердого тела примерно одинакова. При упаковке частиц в жидкости, так же как и в твердых телах, упорядоченное расположение частиц наблюдается лишь в пределах двух-трех слоев. Это означает, что при фазовом переходе твердое тело- жидкость происходит нарушение симметрии системы. Относительные положения молекул в жидкости не фиксированы. Под действием внешней силы жидкость течет, сохраняя свой объем, и принимая форму сосуда. Текучесть жидкости объясняется тем, что перескоки молекул из одного положения равновесия в другое происходят преимущественно в направлении действия внешней силы. Вещество в жидком состоянии существует в определённом интервале температур, ниже которого переходит в твердое состояние (происходит кристаллизация либо превращение в твердотельное аморфное состояние — стекло), выше — в газообразное (происходит испарение). Границы этого интервала зависят от давления. Как правило, вещество в жидком состоянии имеет только одну модификацию. Все жидкости принято делить на чистые жидкости и смеси. Некоторые смеси жидкостей имеют большое значение для жизни: кровь, морская вода и др. Жидкости могут выполнять функцию растворителей. Жидкость чрезвычайно трудно сжать механически, поскольку, в отличие от газа, между молекулами очень мало свободного пространства. Давление, производимое на жидкость, заключенную в сосуд, передаётся без изменения в каждую точку объёма этой жидкости. Эта особенность, наряду с очень малой сжимаемостью, используется в гидравлических машинах.
ТВЕРДЫЕ ТЕЛА
Твёрдое тело — это одно из четырёх агрегатных состояний вещества, отличающееся от других агрегатных состояний (жидкости, газов, плазмы) стабильностью формы и характеромтеплового движения атомов, совершающих малые колебания около положений равновесия. Вещество находится в твердом состоянии, если средняя потенциальная энергия притяжения молекул много больше их средней кинетической энергии. Различают кристаллические и аморфные твёрдые тела. Аморфные тела – конденсированные вещества, атомная структура которых имеет ближний порядок, и не имеет дальнего порядка, характерного для кристаллических структур. Кристаллические тела – твердые тела, в которых атомы расположены закономерно, образую кристаллическую решетку. Молекулы в твердом теле располагаются упорядоченно. Упаковка молекул в пространстве аналогична заполнению плоскости правильными многоугольниками. Частицы твердого тела, образуя кристаллическую решетку, колеблются около некоторых средних положений равновесия, называемых узлами кристаллической решетки. Колебания молекул возможны по различным направлениям и могут иметь разную амплитуду. Значительная средняя потенциальная энергия взаимодействия препятствует изменению среднего расстояния между ними. Следствиями этого является сохранение твердыми телами формы и объема. В прошлом твёрдое тело применялось как конструкционный материал и в основе употребления лежали непосредственно ощутимые механические свойства как твёрдость, масса, пластичность, упругость, хрупкость. В современном мире применение твёрдого тела основывается на физических свойствах, которые зачастую обнаруживаются только при лабораторных исследованиях.
ПЛАЗМА

Плазма— частично или полностью ионизированный газ, образованный из нейтральных атомов (или молекул) и заряженных частиц (ионов и электронов). Важнейшей особенностью плазмы является то что не смотря на наличие свободных зарядов, суммарный электрический заряд плазмы приблизительно равен нулю, это означает, что объемные плотности положительных и отрицательных заряженных частиц, из которых она образована, оказываются почти одинаковыми. Плазма иногда называется четвёртым (после твёрдого, жидкого и газообразного) агрегатным состоянием вещества. Присутствие свободных электрических зарядов делает плазму проводящей средой, что обуславливает ее заметно большее взаимодействие с магнитным и электрическим полями. Классификация Плазма обычно разделяется на идеальную и неидеальную, низкотемпературную и высокотемпературную, равновесную и неравновесную, при этом довольно часто холодная плазма бывает неравновесной, а горячая равновесной. Плазму делят на низкотемпературную (температура меньше миллиона K) и высокотемпературную (температура миллион K и выше). Такое деление обусловлено важностью высокотемпературной плазмы в проблеме осуществления управляемого термоядерного синтеза. Разные вещества переходят в состояние плазмы при разной температуре, что объясняется строением внешних электронных оболочек атомов вещества: чем легче атом отдает электрон, тем ниже температура перехода в плазменное состояние. В неравновесной плазме электронная температура существенно превышает температуру ионов. Это происходит из-за различия в массах иона и электрона, которое затрудняет процесс обмена энергией. Такая ситуация встречается в газовых разрядах, когда ионы имеют температуру около сотен, а электроны около десятков тысяч K. В равновесной плазме обе температуры равны. Поскольку для осуществления процесса ионизации необходимы температуры, сравнимые с потенциалом ионизации, равновесная плазма обычно является горячей (с температурой больше нескольких тысяч K). Степень ионизации Для того, чтобы газ перешел в состояние плазмы, его необходимо ионизировать. Степень ионизации пропорциональна числу атомов, отдавших или поглотивших электроны, и больше всего зависит от температуры. Даже слабо ионизированный газ, в котором менее 1 % частиц находятся в ионизированном состоянии, может проявлять некоторые типичные свойства плазмы (взаимодействие с внешним электромагнитным полем и высокая электропроводность). Ионизация- процесс образования ионов из атомов. Для низкотемпературной плазмы характерна малая степень ионизации (до 1 %). Так как такие плазмы довольно часто употребляются в технологических процессах, их иногда называют технологичными плазмами Горячая плазма почти всегда полностью ионизирована (степень ионизации ~100 %). Обычно именно она понимается под «четвертым агрегатным состоянием вещества». Примером может служить Солнце. Помимо температуры, которая имеет фундаментальную важность для самого существования плазмы, вторым наиболее важным свойством плазмы является плотность. Словосочетание плотность плазмы обычно обозначает плотность электронов, то есть число свободных электронов в единице объёма.
Формы плазмы:
Искусственно созданная плазма – Плазменные ракетные двигатели, плазменные лампы, светящая сфера ядерного взрыва и др.
Земная природная плазма – Молния, Северное сияни и др.
Космическая плазма – Солнце и другие звезды, космическое пространство и др.
Опыт: изменение агрегатного состояния воды
1.Берем лед( твердое состояние воды)
2.Нагреваем его до перехода в жидкое состояние
3.Нагреваем до кипения и перехода в газообразное состояние
Заключение
Подведем итоги проделанной работы:
Газ – агрегатное состояние вещества, в котором его частицы не связаны или весьма слабо связаны силами взаимодействия и движутся свободно, заполняя весь предоставленный им объём.
Жидкость – агрегатное состояние вещества, промежуточное между твёрдым и газообразным состояниями. Жидкость, сохраняя отдельные черты как твёрдого тела, так и газа, обладает, однако, рядом только ей присущих особенностей, из которых наиболее характерная - текучесть. Подобно твёрдому телу, жидкость сохраняет свой объём, имеет свободную поверхность.
Твёрдое тело – одно из четырёх агрегатных состояний вещества, отличающееся от других агрегатных состояний стабильностью формы и характером теплового движения атомов, совершающих малые колебания около положений равновесия. Кристаллы характеризуются дальним порядком в расположении атомов. В аморфных телах дальний порядок отсутствует.
Плазма – частично или полностью ионизованный газ, в котором плотности положительных и отрицательных зарядов практически одинаковы.
Выполнил: Латышев Аркадий